vídeos sobre nacionalización del azúcar y la sal
QUIMICA ORGANICA E INORGANICA
http://www.areaciencias.com/preguntas-atomo.htm
http://www.areaciencias.com/EJERCICIOS%20AUTOEVALUACION/crucigrama%20la%20materia.htm
http://www.areaciencias.com/EJERCICIOS%20AUTOEVALUACION/LA%20MATERIA/la%20materia.htm
http://www.educaplay.com/es/recursoseducativos/tag/crucigrama_de_quimica
crucigramas de diferentes temas de química

QUIMICA: la ciencia que estudia tanto la composición, estructura y propiedades de la materia como los cambios que ésta experimenta durante las reacciones quimicas y su relación con la energia.
QUIMICA ORGANICA: Química del carbono es la rama de la química que estudia una clase numerosa de moleculas que contienencarbono formando enlaces covalentes carbono-carbono o carbono-hidrogeno, también conocidos como compuestos orgánicos.
INSTRUMENTOS DE LABORATORIO DE QUIMICA
Objetivo: Conocer los instrumentos de laboratorio y la función de cada uno.
En el laboratorio y en las prácticas es esencial la utilización de instrumentos para el manejo de los químicos y demás aparatos contenidos en él.
La mayoría son de vidrio por su facilidad para la limpieza, transparencia, inercia química, capacidad para soportar altas temperaturas. El inconveniente de estos instrumentos está en su fragilidad y costos, implicando gran responsabilidad en el manejo de los mismos.
LIMPIEZA DEL MATERIAL VIDRIO
Es necesario para evitar contaminación de reactivos y disoluciones. Una vez utilizado debe limpiarse, sino se hace inmediatamente debe colocarse en un recipiente con agua y jabón neutro. Usar los escobillones necesarios para cada instrumento, si los componentes ya están secos debe utilizarse la siguiente mezcla ( 20 gr de dicromato de potasio + 50 ml de agua, después se añade acido sulfúrico concentrado hasta el volumen aproximadamente 100 ml) luego se juaga con abundante agua de grifo y luego agua destilada.
descargue la funciones, e implementos de laboratorio
http://upnfmbioquimica.blogspot.com/p/laboratorio-de-presencia-de.html

CONOZCAMOS LOS SOLIDOS Y SUS CARACTERISTICAS
LOS SOLIDOS:
Se caracterizan porque las partículas se conservan unidas en posición fija y rígida, con poco movimiento.
Las características generales de los sólidos son: forma, volumen, elasticidad, fragilidad, dureza, flotación, inercia, tenacidad, maleabilidad, ductilidad, densidad, difusión.

Forma: Tienen forma definida, son relativamente rígidos y no fluyen como lo hacen los gases y los líquidos, excepto a bajas presiones extremas.
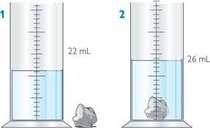
Volumen: Debido a que tienen una forma definida, su volumen también es constante.

Elasticidad: Un sólido recupera su forma original cuando es deformado. Un resorte es un objeto en que podemos observar esta propiedad.

Fragilidad: Un sólido puede romperse en muchos pedazos (quebradizo).

Dureza: hay sólidos que no pueden ser rayados por otros más blandos. El diamante es un sólido con dureza elevada.

Flotación: Algunos sólidos cumplen con esta propiedad, solo si su densidad es menor a la del líquido en el cual se coloca.

Inercia: es la dificultad o resistencia que opone un sistema físico o un
sistema social a posibles cambios, en el caso de los sólidos pone resistencia a cambiar su estado de reposo.

Tenacidad: En ciencia de los Materiales la tenacidad es la resistencia que opone un material a que se propaguen fisuras o grietas.

Maleabilidad: Es la propiedad de la materia, que presentan los cuerpos a ser labrados por deformación. La maleabilidad permite la obtención de delgadas láminas de material sin que éste se rompa, teniendo en común que no existe ningún método para cuantificarlas.

Ductilidad: La ductilidad se refiere a la propiedad de los sólidos de poder obtener hilos de ellos.
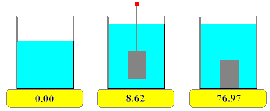
Densidad. Los sólidos presentan densidades relativamente altas con relación a los de los líquidos y los gases. Debido a la cercanía de sus moléculas por eso se dice que son más “pesados”

Difusión: los sólidos se difunden(se reparten en el espacio) o se mezclan con mucha lentitud, debido a las fuerzas de atracción, entre sus partículas, estas ocupan posiciones fijas y por lo tanto el movimiento es lento.

CRISTALIZACION
La mayor parte de los sólidos presentes en la naturaleza son cristalinos aun cuando en ocasiones esa estructura ordenada no se refleje en una forma geométrica regular apreciable a simple vista. Ello es debido a que con frecuencia están formados por un conjunto de pequeños cristales orientados de diferentes maneras, en una estructura policristalina. Los componentes elementales de una red cristalina pueden ser átomos, moléculas o iones, de ahí que no se pueda hablar en general de la molécula de un cristal, sino más bien de un retículo elemental o celdilla unidad, que se repite una y otra vez en una estructura periódica o red cristalina.

Dependiendo del alcance del orden espacial de la estructura interna en la materia y su distribución en la misma podemos distinguir entre:

Monocristal: Presenta una fuerte interacción entre sus componentes los cuales describen una mínima oscilación con poca energía potencial. Las partículas están dispuestas de acuerdo a un orden en el espacio que está determinado de acuerdo con una red estructural formada por la "recreación" geométrica de la celdilla unidad en toda la estructura del sólido. Presentan lo que se conoce como Anisotropía.

Policristal: Está compuesto por diversas regiones en las que individualmente se recrea un monocristal aunque las disposiciones de cada una de estas regiones no son simétricas entre sí. Presenta lo que se llama Isotropía estadística.

Amorfos: No presentan una estructura o distribución en el espacio, lo cual los determina como una estructura espacial tridimensional no definida. No se trata de una estructura cristalina.

Según su forma tienen tres dimensiones 8 largo, ancho, profundidad) y los ángulos que se forman entre dichos ejes: cubico, tetragonal, ortorrómbico, hexagonal, monoclínico, triclínico.
Cristales Cúbicos: Presentan tres ejes perpendiculares de la misma longitud y ángulos de 90 °. Como el Cloruro de Sodio NaCl, sulfuro de plomo ( PbS) y pirita.

Cristales Tetragonales: Los ejes son perpendiculares y dos de ellos tienen la misma longitud y forman ángulos de 90°, Son el oxido de estaño (SnO2), oxido de titanio (TiO2).

Cristales ortorrómbicos: tienen tres ejes perpendiculares dos a dos con longitudes distintas. Los ángulos son de 90° Como el sulfato de bario(BaSO4) y el cloruro de mercurio II (HgCl2) presenta esta red cristalina.

Cristales hexagonales: presentan cuatro ejes e simetría, tres de ellos con la misma longitud y dispuestos en forma simétrica en un plano , el cuarto eje es perpendicular a los demás, presenta dos ángulos de 90° y uno de 120° ejemplo el berilio, sílice (SiO2) y el grafito.

Cristales monoclínicos: tres ejes desiguales, dos de los cuales son perpendiculares al tercero, pero no entre si, tienen dos ángulos de 90° y uno menor de 90°, ejemplo el yeso (CaSO4.2H2O) el clorato de potasio (KClO3) y el sulfuro de arsénico (As2S3).

Cristales triclínicos: Son los de menor simetría entre todos los sistemas cristalinos, todos sus ejes son desiguales y no forman ángulos rectos. Como El sulfato de cobre pentahidratado( CuSO4.5H2O), el dicromato de potasio (K2Cr2O79 y la axinita
 INSTITUCIÓN EDUCATIVA ALFREDO GARCIA
INSTITUCIÓN EDUCATIVA ALFREDO GARCIA
